MINI მიმოხილვა
ფორპოსტი კიბოს წინააღმდეგ: მხოლოდ კიბოს უნივერსალური მარკერები
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, შანხაი 200233, ჩინეთი;2 ზოგადი ქირურგიის დეპარტამენტი, ჰარბინის სამედიცინო უნივერსიტეტის პირველი შვილობილი საავადმყოფო, ჰარბინი 150001, ჩინეთი;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, ჩინეთი;4 Ningxia Hui ავტონომიური რეგიონის სახალხო საავადმყოფო, Ningxia სამედიცინო უნივერსიტეტი, Yinchuan 750002, ჩინეთი;5 შანხაის საზოგადოებრივი ჯანმრთელობის კლინიკური ცენტრი და ზოგადი ქირურგიის დეპარტამენტი, ჰუაშანის ჰოსპიტალი და კიბოს მეტასტაზების ინსტიტუტი და რნმ ეპიგენეტიკის ლაბორატორია, ბიოსამედიცინო მეცნიერებათა ინსტიტუტები, შანხაის სამედიცინო კოლეჯი, ფუდანის უნივერსიტეტი, შანხაი 200032, ჩინეთი
ᲐᲑᲡᲢᲠᲐᲥᲢᲣᲚᲘ
კიბო მსოფლიოში სიკვდილიანობის წამყვანი მიზეზია.კიბოს ადრეულმა გამოვლენამ შეიძლება შეამციროს ყველა სახის კიბოს სიკვდილიანობა;თუმცა, ეფექტური ადრეული გამოვლენის ბიომარკერები აკლია კიბოს უმეტესობის სახეობებს.დნმ-ის მეთილაცია ყოველთვის იყო ინტერესის მთავარი სამიზნე, რადგან დნმ-ის მეთილაცია ჩვეულებრივ ხდება სხვა გენეტიკურ ცვლილებებამდე.კიბოს საერთო მახასიათებლების გამოკვლევისას დნმ-ის მეთილაციის ახალი სახელმძღვანელოს პოზიციონირების თანმიმდევრობის გამოყენებით, უნივერსალური კიბოს მარკერების სერია (UCOMs) გამოჩნდა, როგორც ძლიერი კანდიდატები კიბოს ადრეული ეფექტური და ზუსტი გამოვლენისთვის.მიუხედავად იმისა, რომ ამჟამინდელი კიბოს ბიომარკერების კლინიკური ღირებულება მცირდება დაბალი მგრძნობელობის და/ან დაბალი სპეციფიკის გამო, UCOM-ის უნიკალური მახასიათებლები უზრუნველყოფს კლინიკურად მნიშვნელოვან შედეგებს.UCOM-ების კლინიკური პოტენციალის დადასტურება ფილტვის, საშვილოსნოს ყელის, ენდომეტრიუმის და უროთელიუმის კიბოებში შემდგომში ხელს უწყობს UCOM-ების გამოყენებას კიბოს მრავალ ტიპსა და სხვადასხვა კლინიკურ სცენარებში.ფაქტობრივად, UCOM-ის აპლიკაციები ამჟამად მიმდინარეობს აქტიური გამოკვლევის ქვეშ, შემდგომი შეფასებით კიბოს ადრეულ გამოვლენაში, დამხმარე დიაგნოზში, მკურნალობის ეფექტურობასა და რეციდივების მონიტორინგში.მოლეკულური მექანიზმები, რომლითაც UCOM-ები აღმოაჩენენ კიბოს, შემდეგი მნიშვნელოვანი თემაა, რომელიც უნდა გამოვიკვლიოთ.UCOM-ების გამოყენება რეალურ სცენარებში ასევე მოითხოვს დანერგვას და დახვეწას.
საკვანძო სიტყვები
კიბოს გამოვლენა;კიბოს სკრინინგი;დნმ-ის მეთილაცია;კიბოს ეპიგენეტიკა;კიბოს ბიომარკერები
რატომ გვჭირდება სასწრაფოდ ახალი ბიომარკერები?
საუკუნეზე მეტი ხნის განმავლობაში კიბოს წინააღმდეგ ბრძოლის შემდეგ კიბო კვლავ ყველაზე მომაკვდინებელი ბიოლოგიური საფრთხეა კაცობრიობისთვის.კიბო რჩება გლობალურ ჯანმრთელობის პრობლემად, 20201 წელს 19,3 მილიონი ახალი შემთხვევისა და თითქმის 10 მილიონი სიკვდილით.გარდა ამისა, ჩინეთში 2020 წელს დაახლოებით 3 მილიონი სიკვდილი დაფიქსირდა კიბოთი, რაც გლობალური კიბოსთან დაკავშირებული სიკვდილიანობის 30% იყო1.ეს სტატისტიკა მიუთითებს, რომ ჩინეთი პირველ ადგილზეა კიბოს შემთხვევების და სიკვდილიანობის მაჩვენებლით.უფრო მეტიც, კიბოს 5-წლიანი გადარჩენის მაჩვენებელი 40,5%-ია, რაც 1,5-ჯერ დაბალია, ვიდრე 5-წლიანი გადარჩენის მაჩვენებელი შეერთებულ შტატებში2,3.შედარებით დაბალი გადარჩენისა და სიკვდილიანობის მაღალი მაჩვენებლები ჩინეთში, ვიდრე ადამიანთა განვითარების მაღალი ინდექსის მქონე ქვეყნებში, მიუთითებს იმაზე, რომ სასწრაფოდ საჭიროა კიბოს პრევენციისა და მეთვალყურეობის ეფექტური და ეკონომიური სისტემა.კიბოს ადრეული გამოვლენა ჯანდაცვის სისტემის ერთ-ერთი ყველაზე მნიშვნელოვანი ელემენტია.კიბოს ადრეულ გამოვლენას შეუძლია გააუმჯობესოს პროგნოზი და გადარჩენა ადრეულ ეტაპზე კიბოს თითქმის ყველა ტიპის4.წარმატებულმა სკრინინგის სტრატეგიებმა გამოიწვია საშვილოსნოს ყელის, სარძევე ჯირკვლის, კოლორექტალური და პროსტატის კიბოს შემთხვევებისა და სიკვდილიანობის მაჩვენებლების მნიშვნელოვანი შემცირება.
თუმცა, კიბოს ადრეული გამოვლენის მიღწევა ადვილი საქმე არ არის.ადრეული კიბოს ბიოლოგიისა და პროგნოზის გამოკვლევა, ადრეული გამოვლენის საიმედო ბიომარკერების იდენტიფიცირება და დადასტურება და ადრეული გამოვლენის ხელმისაწვდომი და ზუსტი ტექნოლოგიების შემუშავება ყოველთვის იყო ყველაზე დიდი დაბრკოლება ამ პროცესში4.კიბოს ზუსტი გამოვლენამ შეიძლება განასხვავოს კეთილთვისებიანი და ავთვისებიანი დაზიანებები, რაც ხელს უწყობს არასაჭირო პროცედურების თავიდან აცილებას და ხელს უწყობს დაავადების შემდგომ მართვას.ადრეული გამოვლენის ამჟამინდელი სტრატეგიები მოიცავს ენდოსკოპზე დაფუძნებულ ბიოფსიებს, სამედიცინო ვიზუალიზაციას, ციტოლოგიას, იმუნოანალიზს და ბიომარკერის ტესტებს5-7.ინტრუზიული და ძვირადღირებული, ენდოსკოპზე დაფუძნებული ბიოფსიები არსებითად მძიმე ტვირთად ატარებს, როგორც ძირითად სამედიცინო პროცედურას, რომელიც ეყრდნობა პროფესიონალ პერსონალს.ციტოლოგიის მსგავსად, სკრინინგის ორივე მეთოდი დამოკიდებულია სამედიცინო პროფესიონალებზე და ეფუძნება პიროვნულ განსჯას, რომელიც შორს არის იდეალურისგან8.ამის საპირისპიროდ, იმუნოანალიზები ძალიან არაზუსტია, ცრუ დადებითი მაღალი მაჩვენებლების გათვალისწინებით.სამედიცინო ვიზუალიზაცია, როგორც სკრინინგის ტაქტიკა, მოითხოვს ძვირადღირებულ აღჭურვილობას და სპეციალიზებულ ტექნიკოსებს.აქედან გამომდინარე, სამედიცინო გამოსახულება უკიდურესად შეზღუდულია დაბალი ხელმისაწვდომობის გამო.ყველა ამ მიზეზის გამო, ბიომარკერები, როგორც ჩანს, უკეთესი ვარიანტია კიბოს ადრეული გამოვლენისთვის.
მიმოწერა: იინშან ლი და ვენჩიანგ იუ
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ORCID ID: https://orcid.org/0009-0005-3340-6802 და
https://orcid.org/0000-0001-9920-1133
მიღებულია 2023 წლის 22 აგვისტოს;მიღებულია 2023 წლის 12 ოქტომბერს;
გამოქვეყნდა ონლაინ 2023 წლის 28 ნოემბერს.
ხელმისაწვდომია www.cancerbiomed.org
©2023 კიბოს ბიოლოგია და მედიცინა.Creative Commons
Attribution-არაკომერციული 4.0 საერთაშორისო ლიცენზია
ბიომარკერები ამჟამად კლასიფიცირდება როგორც ცილები, დნმ-ის მუტაციის მარკერები, ეპიგენეტიკური მარკერები, ქრომოსომული ანომალიები, რნმ მარკერები, რომლებიც უშუალოდ სიმსივნეებიდან მიიღება, ან სხეულის სითხეებიდან ირიბად მიღებული სიმსივნის ფრაგმენტები.ცილის მარკერები არის ყველაზე ფართოდ გამოყენებული ბიომარკერები კიბოს სკრინინგსა და დიაგნოზში.ცილის ბიომარკერები, როგორც სკრინინგის ბიომარკერები, შეზღუდულია კეთილთვისებიანი დაზიანებების ზემოქმედების ტენდენციით, რაც იწვევს ზედმეტ დიაგნოზს და ზედმეტ მკურნალობას, როგორც მოხსენებულია α-ფეტოპროტეინისა და პროსტატის სპეციფიკური ანტიგენისთვის (PSA)9,10.რნმ მარკერები მოიცავს გენეტიკურ ექსპრესიის ნიმუშებს და რნმ-ის სხვა არაკოდირებულ მარკერებს. რნმ-ის გენეტიკური ექსპრესიის მარკერების ერთობლიობა შეიძლება გამოვლინდეს შარდის ნიმუშების გამოყენებით, რომელთა მგრძნობელობა შორს იყო დამაკმაყოფილებელი (60%) პირველადი სიმსივნეებისთვის და რომელთა გამოვლენა შესაძლებელია. გავლენას მოახდენს რნმ-ის ადვილად დეგრადაციის ბუნებით ნორმალურ გარემოში11.გენეტიკური და ეპიგენეტიკური მარკერები სიმსივნეებში პრევალენტობის და კიბოს ტიპების შეზღუდვის პრობლემას აწყდებიან.
დნმ-ის მეთილაცია იყო ძლიერი კანდიდატი, როგორც ადრეული გამოვლენის ბიომარკერი მას შემდეგ, რაც პირველად დაუკავშირა ფეინბერგმა კიბოს 1983 წელს12. დნმ-ის მეთილაციის აბერაციები შეინიშნება კიბოს ყველა სტადიაზე, ჯერ კიდევ კიბოსწინა სტადიაზე.დნმ-ის აბერანტული ჰიპერმეთილაცია ჩვეულებრივ ხდება CpG კუნძულებზე გენის პრომოტორებში სიმსივნის სუპრესორების საწინააღმდეგოდ13,14.კვლევებმა ასევე აჩვენა, რომ დნმ-ის არანორმალური ჰიპერმეთილაცია მონაწილეობს განვითარების რეგულატორების ზერეგულაციაში15.დნმ-ის მეთილაციის ველი, რომელიც ჩვეულებრივ ასოცირდება განვითარების რეგულატორებთან და ჰიპერმეთილირებულ კიბოებთან, შესაძლოა შეცვალოს გენის ექსპრესიის რეჟიმი უფრო სტაბილურ დნმ-ის მეთილაციაზე დამოკიდებულ რეჟიმში და შეამციროს კავშირი მეთილირებულ ჰისტონთან H3K27me3 და ასოცირებულ პოლიკომბ ცილებთან16,17.
გამოქვეყნებული დნმ-ის მეთილაციის მარკერების დიდ რაოდენობას შორის, რამდენიმე წარმატებით შედგა ბაზარზე;თუმცა, ამჟამინდელი კომერციული დნმ-ის მეთილაციის მარკერები და სადიაგნოსტიკო პანელები ჯერ კიდევ სრულად არ ხსნიან კიბოს ადრეული გამოვლენის პოტენციალს მრავალი მიზეზის გამო18.მიუხედავად იმისა, რომ ძირითადად აჩვენებს მისაღებ შესრულებას მონაცემთა ბაზის ინფორმაციის გამოყენებით, ეს ბიომარკერები ჩვეულებრივ ნაკლებად იდეალურად მოქმედებენ რეალურ სამყაროში იმის გამო, რომ რეალური სამყაროს ნიმუშები ხშირად უფრო რთული და არა ისეთი რეპრეზენტატიულია, როგორც მონაცემთა ბაზებში შერჩეული.შემდეგი თაობის თანმიმდევრობაზე დაფუძნებული მრავალკიბოს მეთილაციის ადრეულ გამოვლენას აჩვენა მხოლოდ 16.8% და 40.4% მგრძნობელობა I და II სტადიის კიბოებში, შესაბამისად19.ადრეული გამოვლენის ტესტები მოითხოვს უფრო მეტ სტაბილურობას და უფრო ზუსტ ბიომარკერებს.
უნივერსალური კიბოს მარკერის (UCOM) აღმოჩენა სახელმძღვანელო პოზიციონირების თანმიმდევრობის (GPS) გამოყენებით
კიბოს ათწლეულის კვლევის მიუხედავად, დამაკმაყოფილებელი პრევენცია და მკურნალობა არ არის განხორციელებული.საჭიროა ახალი მეთოდოლოგიები, რათა მკვლევარებმა შეძლონ კიბოს საფუძვლიანი შეფასება.ბოლო 23 წლის განმავლობაში, კიბოს 6 დამახასიათებელი ნიშანი, როგორიცაა აპოპტოზის თავიდან აცილება, ქსოვილის ინვაზია და მეტასტაზები და ა.კიბოსთან დაკავშირებული მეტი დეტალების გამოვლენის შემდეგ, კიბოს კვლევაში უფრო მეტი პერსპექტივაა დანერგილი.კიბოს კვლევა თანდათანობით შევიდა ახალ ეპოქაში ორი მიმართულებით (საერთო და ინდივიდუალურობა).ბოლო წლების ზუსტი ონკოლოგიის განვითარებით, კიბოს კვლევის ფოკუსი მიდრეკილია ინდივიდუალური მიზნობრივი თერაპიისკენ და კიბოს ჰეტეროგენურობისკენ22.ამრიგად, ახლახან გამოვლენილი კიბოს ბიომარკერები ძირითადად ფოკუსირებულია კიბოს სპეციფიკურ ტიპებზე, როგორიცაა PAX6 ფორსერვიკალური კიბო23 და BMP3 კოლორექტალური კიბოსთვის24.კიბოს ტიპებისთვის დამახასიათებელი ამ ბიომარკერების მოქმედება განსხვავებულია, მაგრამ მგრძნობიარე პირებისთვის ჯერ კიდევ შეუძლებელია, გაიარონ სკრინინგი ყველა კიბოსთვის ერთდროულად, ბიოლოგიური ნიმუშის შეძენის შეზღუდვისა და მაღალი ღირებულების გამო.იდეალური იქნება, თუ ჩვენ შევძლებთ ერთიანი, ძლიერი ბიომარკერის იდენტიფიცირებას, რომელიც ეფექტურია ყველა ტიპის კიბოსთვის ადრეულ ეტაპზე.
ასეთი იდეალური მიზნის მისაღწევად, უკეთესი ბიომარკერის კანდიდატი უნდა შეირჩეს პოტენციური ბიომარკერების ტიპების სიიდან.დნმ-ის მეთილაციის აბერაციები, ყველა გენეტიკურ და ეპიგენეტიკურ პროფილებს შორის, ცნობილია, რომ დაკავშირებულია კიბოსთან და არის ერთ-ერთი ყველაზე ადრეული, თუ არა პირველი, კიბოსთან დაკავშირებული ანომალიები ქრონოლოგიურად.დნმ-ის მეთილაციის გამოკვლევა ადრე დაიწყო, მაგრამ შეფერხდა კვლევის მეთოდების ნაკლებობამ.გენომში არსებულ 28 მილიონ პოტენციურ მეთილირებული CpG უბნებს შორის, უნდა გამოვლინდეს მართვადი რაოდენობა და შეესაბამებოდეს გენომს სიმსივნის წარმოშობის უკეთ გასაგებად.მთლიანი გენომის ბისულფიტის თანმიმდევრობა (WGBS), რომელიც მიჩნეულია დნმ-ის მეთილაციის თანმიმდევრობის ოქროს სტანდარტად, შეუძლია დაფაროს კიბოს უჯრედებში Cs-ის მხოლოდ 50%-ს ბისულფიტის მკურნალობის ბუნების გამო, რომელიც ანადგურებს დნმ-ის ფრაგმენტებს და ამცირებს გენომის სირთულეს. Cs-to-Ts25-ის ტრანსფორმაცია.სხვა მეთოდები, როგორიცაა 450 ათასი ჩიპი, ფარავს გენომის მეთილაციის მხოლოდ 1.6%-ს.450 ათასი მონაცემების საფუძველზე, დნმ-ის მეთილაციის აღმოჩენის პანელს აქვს 35.4% მგრძნობელობა I სტადიის კიბოს 6 ტიპისთვის26.კიბოს ტიპების შეზღუდვა, ცუდი შესრულება და ანალიტიკურ პროცესში გამოვლენის მეთოდებით წარმოქმნილი ხმაური გახდა ყველაზე დიდი დაბრკოლება პან-კიბოს გამოვლენის პანელებისთვის.
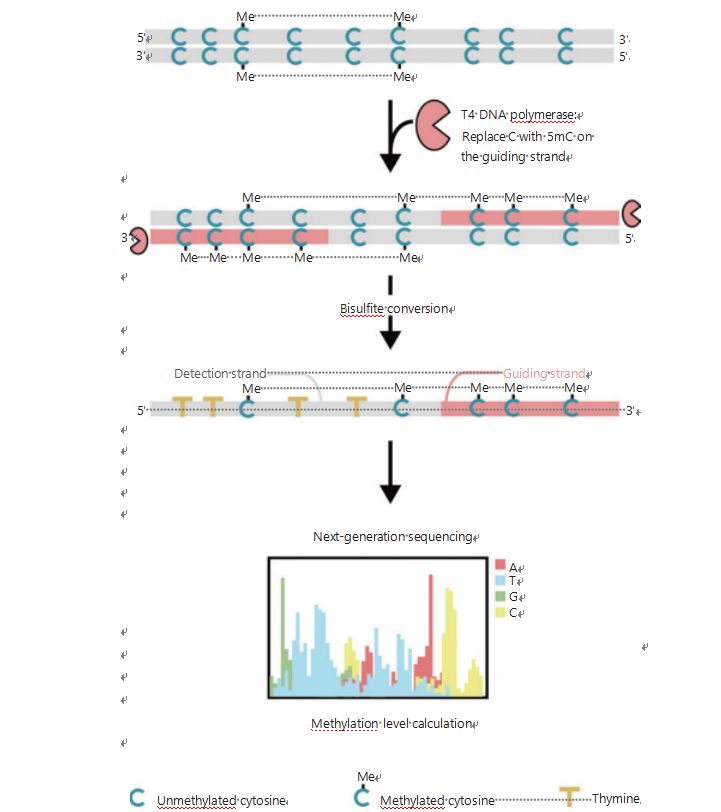
სიმსივნისა და მეტასტაზების დროს უჯრედების ეპიგენეტიკური შაბლონების უკეთ გამოსაკვლევად, ჩვენ შევიმუშავეთ უნიკალური GPS გენომის მასშტაბით დნმ-ის მეთილაციის გამოვლენისთვის, რომელიც მოიცავს CpG უბნების 96%-მდე 0,4 მილიარდ კითხვაში25.GPS არის ორმხრივი თანმიმდევრობის მეთოდი, რომელიც იყენებს არაკონვერტირებად მეთილ-ციტოზინების დნმ-ის ფრაგმენტის 3' ბოლოს ბისულფიტით დამუშავების შემდეგ, რომელიც ხელმძღვანელობს დნმ-ის მეთილაციის გაანგარიშების გასწორებას 5' ბოლოდან წყვილ-ბოლო თანმიმდევრობით (სურათი 1)25.მეთილ-ციტოზინის სახელმძღვანელო ჯაჭვი, რომელიც მოქმედებს როგორც შაბლონი, ხელს უწყობს მაღალი GC რეგიონის გასწორებას, რომელიც აღადგენს ყველაზე მიტოვებულ თანმიმდევრობის მონაცემებს ტრადიციულ WGBS-ში.GPS-ის მაღალი დაფარვის მახასიათებელი გვაწვდის დნმ-ის მეთილაციის უზარმაზარ ინფორმაციას, რაც საშუალებას გვაძლევს შევისწავლოთ კიბოს მეთილაციის პროფილები გაცილებით მაღალი გარჩევადობით ადრე გამოკვლეულ რეგიონებში.
GPS გვაწვდის მძლავრ ინსტრუმენტს კიბოს ჰომოგენურობის გამოსაკვლევად, რომელსაც შეუძლია მნიშვნელოვნად გაამარტივოს კიბოს კვლევა და პოტენციურად იპოვოთ სიმსივნისა და მეტასტაზების უნივერსალური ახსნა.სიმსივნური უჯრედების ხაზების GPS მონაცემების გაანალიზებისას ხშირად გვხვდება უნიკალური ფენომენი.იყო მთელი რიგი რეგიონები, რომლებიც, როგორც ჩანს, არანორმალურად ჰიპერმეთილირებული იყო მრავალი ტიპის კიბოს ნიმუშებში.ეს მოულოდნელი აღმოჩენა შემდგომში დადასტურდა, რომ ემსახურებოდეს როგორც UCOM.კიბოს გენომის ატლასის (TCGA) მონაცემთა ბაზაში გაანალიზებულია 7000-ზე მეტი ნიმუში 17 ტიპის კიბოსგან, რომელთა შორის ჩვენ გამოვავლინეთ პირველი UCOM, HIST1H4F, ჰისტონთან დაკავშირებული გენი, რომელიც ჰიპერმეთილირებულია კიბოს ყველა ტიპში27.შემდეგ UCOM-ების სერია იქნა ნაპოვნი და დამოწმებული TCGA მონაცემთა ბაზაში, Gene Expression Omnibus (GEO) მონაცემთა ბაზაში და რეალურ სამყაროში არსებულ კლინიკურ ნიმუშებში.ამ დროისთვის, HIST1H4F, PCDHGB7 და SIX6 იქნა ნაპოვნი და დამოწმებული, როგორც UCOM.UCOM-ების მოულოდნელი აღმოჩენა გვთავაზობს მძლავრ პასუხს კიბოს ადრეული გამოვლენის აუცილებლობაზე.UCOM-ები უზრუნველყოფენ გამოსავალს მრავალჯერადი კიბოს ერთი მარკერის გამოვლენისთვის.
UCOM-ის მახასიათებლები
ვალიდაციის შემდეგ, UCOM-ები ავლენენ ოთხ ძირითად მახასიათებელს, რაც საშუალებას აძლევს UCOM-ს გადააჭარბოს მიმდინარე ბიომარკერების ეფექტურობას (სურათი 2).
უნიკალური ავთვისებიანობისთვის
UCOM-ები უნიკალურია სიმსივნური ან კიბოსწინარე დაზიანებებისთვის და მათზე არ მოქმედებს ნორმალური ფიზიოლოგიური ცვლილებები.კიბოსთან დაკავშირებული ზოგიერთი ამჟამინდელი მარკერი, რომელიც ფართოდ იქნა გამოყენებული ადრეული გამოვლენისა და/ან სკრინინგისთვის, გამოიწვია ზედმეტად დიაგნოზირებამდე.PSA-ს ამაღლებული დონეები, კლინიკურად აკრედიტებული სკრინინგის ინსტრუმენტი, ასევე გამოვლენილია კეთილთვისებიან პირობებში, როგორიცაა პროსტატის ჰიპერპლაზია და პროსტატიტი10.გადაჭარბებული დიაგნოსტიკა და შედეგად გადაჭარბებული მკურნალობა იწვევს ცხოვრების ხარისხის დაქვეითებას ნაწლავის, შარდისა და სექსუალური გართულებების გამო28.სხვა პროტეინზე დაფუძნებული და ფართოდ გამოყენებული ბიომარკერები კლინიკურ გარემოში, როგორიცაა CA-125, არ გამოიღო მნიშვნელოვანი სარგებელი გადაჭარბებული დიაგნოსტიკისა და გადაჭარბებული მკურნალობის დროს29.UCOM-ების მაღალი სპეციფიკა ავთვისებიანი სიმსივნეებისთვის თავიდან აიცილებს ამ ხარვეზებს.UCOM, PCDHGB7, ეფექტურად განასხვავებს მაღალი ხარისხის ბრტყელ ინტრაეპითელიალურ დაზიანებებს (HSIL) და საშვილოსნოს ყელის კიბოს ნორმალური ნიმუშებისგან და დაბალი ხარისხის ბრტყელქვეშა ინტრაეპითელიალური დაზიანებებისგან (LSILs), მაშინ როცა სხვა ბიომარკერებს შეუძლიათ მხოლოდ საშვილოსნოს ყელის კიბოს დიფერენცირება ნორმალური ნიმუშებისგან30.მიუხედავად იმისა, რომ PCDHGB7 არ აღმოაჩენს მნიშვნელოვან განსხვავებებს ნორმალურ ენდომეტრიუმსა და ენდომეტრიუმის ჰიპერპლაზიას შორის, მნიშვნელოვანი განსხვავებებია გამოვლენილი ნორმალურ ენდომეტრიუმსა და ატიპიურ ჰიპერპლაზიას შორის და კიდევ უფრო დიდი განსხვავებაა გამოვლენილი ნორმალურ ენდომეტრიუმსა და ენდომეტრიუმის კიბოს (EC) შორის PCDHGB731-ზე დაყრდნობით.UCOM-ები უნიკალურია ავთვისებიანი დაზიანებებისთვის მონაცემთა ბაზებსა და კლინიკურ ნიმუშებში.პაციენტის პერსპექტივიდან, უნიკალური UCOM-ები ამცირებენ ზღურბლს სხვადასხვა ცუდი არასტაბილური ბიომარკერების კომპლექსური ჩვენებების გაგებისა და შეფასების პროცესში შესაბამისი შფოთვის გასაგებად.კლინიკის თვალთახედვით, უნიკალური UCOM-ები განასხვავებენ ავთვისებიან სიმსივნეებს კეთილთვისებიანი დაზიანებებისგან, რაც ხელს უწყობს პაციენტების ტრიაჟს და ამცირებს არასაჭირო სამედიცინო პროცედურებსა და ზედმეტ მკურნალობას.აქედან გამომდინარე, უნიკალური UCOM-ები ამცირებს სამედიცინო სისტემის სიჭარბეს, ათავისუფლებს სისტემის დისტრესს და ხელმისაწვდომს ხდის უფრო მეტ სამედიცინო რესურსს გაჭირვებულთათვის.
ნახაზი 1 GPS სამუშაო ნაკადის სქემა დნმ-ის მეთილაციის გამოვლენისთვის25.რუხი ხაზი: შეყვანის დნმ-ის თანმიმდევრობა;წითელი ხაზი: დნმ დამუშავებული T4 დნმ პოლიმერაზათი, ციტოზინის ჩანაცვლება 5'-მეთილციტოზინით შეყვანის 3' ბოლოს;ლურჯი C ერთად Me: მეთილირებული ციტოზინი;ლურჯი C: არამეთილირებული ციტოზინი;ყვითელი T: თიმინი25.
Ყველაფერი ან არაფერი
UCOM-ები გვხვდება მხოლოდ კიბოს უჯრედებში და სტაბილურად აღმოჩენილია თითქმის ყველა კიბოს უჯრედში.HIST1H4F დადასტურდა, რომ ჰიპერმეთილირებული იყო სიმსივნის თითქმის ყველა ტიპში, მაგრამ არა ნორმალურ ნიმუშებში27.ანალოგიურად, PCDHGB7 და SIX6 ასევე ნაჩვენებია ჰიპერმეთილირებული სიმსივნის ყველა ნიმუშში, მაგრამ არა ნორმალურ ნიმუშებში30-32.ეს უნიკალური მახასიათებელი მნიშვნელოვნად აუმჯობესებს UCOM-ების მუშაობას აღმოჩენისა და მგრძნობელობის ლიმიტის მიმართ.კიბოს უჯრედების მხოლოდ 2% შეიძლება დიფერენცირებული იყოს ნიმუშებში, რაც UCOM-ებს ბევრად უფრო მგრძნობიარე ბიომარკერად აქცევს, ვიდრე არსებული ბიომარკერები30. როგორც კოლორექტალური კიბოს გამოვლენისთვის გამოყენებული ბიომარკერი, KRAS მუტაციები არსებობს კოლორექტალური კიბოს შემთხვევების მხოლოდ დაახლოებით 36%-ში. გვთავაზობს ცუდ დიაგნოსტიკურ პოტენციალს33.კოლორექტალური კიბოს დროს KRAS მუტაციების დაბალი გავრცელება ზღუდავს KRAS-ს სხვა ბიომარკერებთან ერთად.სინამდვილეში, ბიომარკერების ერთობლიობა თავდაპირველად შეიძლება პერსპექტიულად ჩანდეს, მაგრამ ყოველთვის არ იძლევა დამაკმაყოფილებელ შედეგს დეტექტირების ანალიზში გაცილებით დიდი ხმაურის დემონსტრირებისას და ჩვეულებრივ მოიცავს უფრო რთულ ექსპერიმენტულ პროცედურებს.ამის საპირისპიროდ, PCDHGB7 და სხვა UCOM-ები არსებობს ყველა კიბოს დროს.UCOM-ები აღმოაჩენენ კიბოს კომპონენტებს კიბოს სხვადასხვა ტიპის ნიმუშებში მაქსიმალური სიზუსტით, ხოლო აღმოფხვრის კომპლექსური ხმაურის შემცირების ანალიზის პროცესებს.უხვად ნიმუშში კიბოს აღმოჩენა არ არის რთული, მაგრამ მცირე ნიმუშში კიბოს აღმოჩენა უკიდურესად რთულია.UCOM-ებს შეუძლიათ მცირე რაოდენობით კიბოს გამოვლენა.
სურათი 2 UCOM-ების მახასიათებლები.
პათოლოგიური ცვლილებების წინ კიბოს გამოვლენა
UCOM-ების აღმოჩენა შესაძლებელია კიბოსწინარე სტადიაზე პათოლოგიურ ცვლილებებამდე.როგორც ეპიგენეტიკური ბიომარკერები, UCOM ანომალიები წარმოიქმნება უფრო ადრეულ სტადიაზე, ვიდრე ფენოტიპური ანომალიები და შესამჩნევია სიმსივნის გენეზის, პროგრესირებისა და მეტასტაზების დროს34,35.UCOM-ის მგრძნობელობა დროთა განმავლობაში აძლიერებს UCOM-ის მუშაობას კიბოს ადრეულ სტადიაზე და კიბოსწინარე დაზიანებების გამოვლენაში.კიბოს ადრეული გამოვლენა ბიოფსიისა და ციტოლოგიის საფუძველზე შეიძლება იყოს რთული ყველაზე გამოცდილი პათოლოგებისთვისაც კი.კოლპოსკოპიის საშუალებით შეძენილი ერთჯერადი ბიოფსია მოხსენებული იყო, როგორც დადებითი HSIL+ ნიმუშების 60.6%-ში.მრავლობითი დაზიანებისთვის საჭიროა დამატებითი ბიოფსია მგრძნობელობის გასაზრდელად36.ამის საპირისპიროდ, UCOM, PCDHGB7, აქვს მგრძნობელობა 82% HSIL+ ნიმუშებისთვის, რაც აღემატება ბიოფსიების და ბიომარკერების უმეტესობის მგრძნობელობას30.მეთილაციის მარკერს, FAM19A4, აქვს მგრძნობელობა 69% CIN2+-ისთვის, რომელიც ციტოლოგიის მსგავსია, მაგრამ ვერ განასხვავებს CIN1-ს ნორმალური ნიმუშებისგან37.ნაჩვენებია, რომ UCOMs არის ბევრად უფრო მგრძნობიარე ადრეული გამოვლენის ბიომარკერი.გამოცდილებაზე დაფუძნებულ პათოლოგებთან შედარებით, UCOM-ებს აქვთ ადრეული სტადიის კიბოს გამოვლენის უმაღლესი მგრძნობელობა, რაც თავის მხრივ ხელს უწყობს კიბოს პროგნოზს და გადარჩენას30.გარდა ამისა, UCOM-ები გვთავაზობენ გამოვლენის პლატფორმას, რომელიც ხელმისაწვდომია იმ ტერიტორიებისთვის, რომლებსაც არ გააჩნიათ გამოცდილი პათოლოგები და მნიშვნელოვნად აუმჯობესებს გამოვლენის ეფექტურობას.ნიმუშის აღების და გამოვლენის ერთიანი პროცედურების წყალობით, UCOM-ის აღმოჩენა იძლევა სტაბილურ და ადვილად ინტერპრეტაციას შედეგებს, რომლებიც უკეთესად შეეფერება სკრინინგის პროტოკოლს, რომელიც მოითხოვს ნაკლებ პროფესიონალ პერსონალს და სამედიცინო რესურსებს.
ადვილად ამოსაცნობი
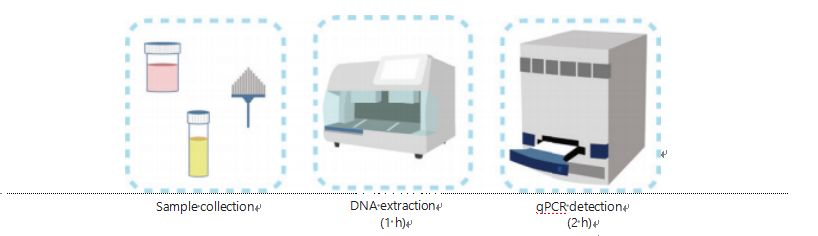
დნმ-ის მეთილაციის გამოვლენის თანამედროვე მეთოდები რთული და შრომატევადია.მეთოდების უმეტესობა მოითხოვს ბისულფიტის ტრანსფორმაციას, რაც იწვევს ნიმუშის ხარისხის დაკარგვას და შესაძლოა არასტაბილურ და არაზუსტ შედეგებს.ბისულფიტის დამუშავებით გამოწვეული ცუდი განმეორებადობა პოტენციურად იწვევს ექიმებისა და პაციენტების დაბნეულობას და შემდგომში ხელს უშლის შემდგომ და/ან მკურნალობის სტრატეგიებს.ამიტომ, ჩვენ შემდგომში შევცვალეთ UCOM-ის გამოვლენის მეთოდი, რათა თავიდან ავიცილოთ ნიმუშების პრობლემური ბისულფიტით დამუშავება, დაკმაყოფილდეს კლინიკური გამოყენების მოთხოვნები და გაზარდოს ხელმისაწვდომობა.ჩვენ შევიმუშავეთ ახალი მეთოდი მეთილაციისადმი მგრძნობიარე შემაკავებელი ფერმენტების გამოყენებით, რეალურ დროში ფლუორესცენტულ რაოდენობრივ PCR-თან (Me-qPCR), რათა განვსაზღვროთ UCOM-ების მეთილაციის სტატუსი 3 საათის განმავლობაში მარტივი დამუშავების პროცედურების გამოყენებით (სურათი 3).Me-qPCR-ს შეუძლია მრავალი ტიპის ნიმუშის მოთავსება, როგორიცაა სხეულის სითხეების კლინიკური შეგროვება და თვითშეგროვებული შარდის ნიმუშები.შეგროვებული კლინიკური ნიმუშები შეიძლება იყოს დამუშავებული, შენახული და ადვილად გაგრძელდეს აღმოჩენა სტანდარტიზებული და ავტომატიზირებული დნმ-ის ექსტრაქციის გამოყენებით.მოპოვებული დნმ შეიძლება შემდეგ პირდაპირ იქნას გამოყენებული Me-qPCR პლატფორმაზე ერთი ქოთნის რეაქციისა და გამომავალი რაოდენობრივი შედეგებისთვის.მარტივი შედეგების ანალიზის შემდეგ კიბოს სპეციფიკურ ტიპებზე მორგებული და დადასტურებული დიაგნოსტიკური მოდელების გამოყენებით, UCOM-ის გამოვლენის შედეგების საბოლოო განსაზღვრა ინტერპრეტირებულია და წარმოდგენილია როგორც ნახევრად რაოდენობრივი მნიშვნელობა.Me-qPCR პლატფორმა აჯობებს ტრადიციულ ბისულფიტ-პიროსთანმიმდევრულობას UCOM-ის გამოვლენისას, ხოლო ზოგავს 3 სთ ბისულფიტის კონვერტაციას, EZ დნმ-ის მეთილაცია-ოქროს ნაკრების პროტოკოლის მიხედვით.მეთილაციის აღმოჩენის ინოვაციური პლატფორმა UCOM-ის გამოვლენას უფრო სტაბილურს, ზუსტს და ხელმისაწვდომს ხდის30.
სურათი 3 UCOM-ების გამოვლენის პროცესი.ნიმუშების ტიპებს მიეკუთვნება პროფესიონალურად აღებული BALF, პაპ-ფუნჯი და/ან თვითშეგროვებული შარდი.დნმ-ის ექსტრაქციის პროცესი შეიძლება მოთავსდეს ავტომატურ ექსტრაქტორთან, რომლის პროდუქტის პირდაპირ აღმოჩენა შესაძლებელია qPCR-ით.
UCOM-ების გამოყენება
ფილტვის კიბო
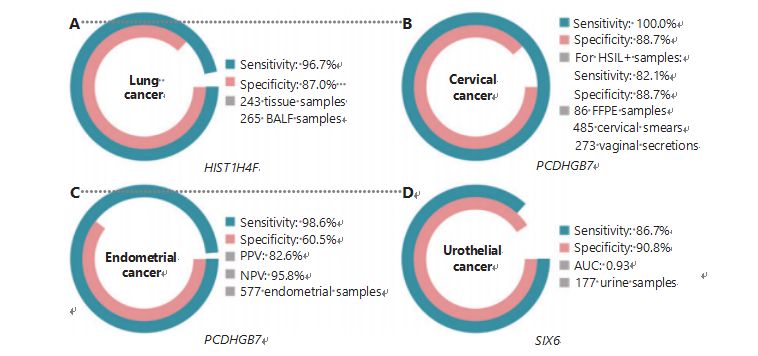
ფილტვის კიბო მსოფლიოში მეორე ყველაზე ხშირად დიაგნოზირებული და ყველაზე ლეტალური კიბოა, რაც შეადგენს ახალი შემთხვევების 11,4%-ს და ახალი სიკვდილიანობის 18,0%-ს1.ყველა დიაგნოზს შორის 85% არის ფილტვის არაწვრილუჯრედოვანი კიბო (NSCLC) და 15% არის წვრილუჯრედოვანი ფილტვის კიბო (SCLC), რომელსაც აქვს ავთვისებიანი სიმსივნეების უფრო მაღალი დონე38.დაბალი დოზით კომპიუტერული ტომოგრაფიის (LDCT) სკანირება ამჟამად რეკომენდებულია ფილტვის კიბოს სკრინინგის მეთოდი და ნაჩვენებია, რომ აუმჯობესებს ადრეულ გამოვლენას და ამცირებს სიკვდილიანობას6;თუმცა, დაბალი სპეციფიკისა და ცუდი ხელმისაწვდომობის გამო, LDCT ჯერ კიდევ არ არის დამაკმაყოფილებელი სკრინინგის მეთოდი, ისევე როგორც სხვა საერთო კიბოს მარკერები, როგორიცაა CEA39.LDCT სკრინინგის სტრატეგიის გამოტოვებული დიაგნოზის და არასწორი დიაგნოზის ხარჯები და პოტენციალი აფერხებს ფილტვის კიბოს სკრინინგის ხელშეწყობის პროგრესს40.HIST1H4F, UCOM, აქვს უზარმაზარი პოტენციალი, როგორც ადრეული გამოვლენის ბიომარკერი ბრონქოალვეოლარული სითხის (BALF) ნიმუშებში27.HIST1H4F ჰიპერმეთილირებულია ფილტვის ადენოკარცინომასა და ფილტვის ბრტყელუჯრედოვან კარცინომაში, გამოვლენის სპეციფიკა 96.7% და მგრძნობელობა 87.0% (სურათი 4A) და განსაკუთრებული ეფექტურობა I სტადიის კიბოსთვის27.HIST1H4F აქვს სპეციფიკა 96.5% და მგრძნობელობა 85.4% NSCLC-სთვის და 96.5% და 95.7%, შესაბამისად, SCLC27.გარდა ამისა, რვა სხვა ტიპის კიბოს ნიმუშებმა, მათ შორის პანკრეასის და კოლორექტალური კიბო, დაადასტურა, რომ HIST1H4F არის ჰიპერმეთილირებული რვავე ტიპში27.
Საშვილოსნოს ყელის კიბოს
საშვილოსნოს ყელის კიბო იყო მეოთხე ყველაზე ხშირად დიაგნოსტირებული კიბო და მეოთხე წამყვანი მიზეზი ქალებში კიბოს სიკვდილიანობის მხრივ 2020 წელს, რაც შეადგენს ახალი შემთხვევების 3.1%-ს და კიბოსთან დაკავშირებული სიკვდილიანობის 3.4%-ს გლობალურად1.2030 წლისთვის საშვილოსნოს ყელის კიბოს აღმოსაფხვრელად, როგორც ამას ჯანმო გვთავაზობს, საშვილოსნოს ყელის კიბოს ადრეული გამოვლენა აუცილებლობას წარმოადგენს.ადრეულ სტადიაზე გამოვლენის შემთხვევაში, 5-წლიანი გადარჩენის მაჩვენებელი აღწევს 92%-ს ინვაზიური საშვილოსნოს ყელის კიბოთი41.ამერიკის კიბოს საზოგადოების (ACS) გაიდლაინები გვთავაზობს საშვილოსნოს ყელის ციტოლოგიურ ტესტებს, პირველადი HPV ტესტებს ან კოტესტებს სკრინინგისთვის42.საშვილოსნოს ყელის ციტოლოგია ინვაზიურია და შეუძლია CIN2+ შემთხვევების მხოლოდ 63.5%-ის გამოვლენა37.
ამის საპირისპიროდ, PCDHGB7 ბევრად უკეთესად მუშაობდა პაპ ნაცხისა და ვაგინალური სეკრეციის გამოყენებით და შეუძლია ეფექტურად განასხვავოს HSIL LSIL-ისგან ულტრა ადრეულ ეტაპზე.მხოლოდ PCDHGB7 აქვს მგრძნობელობა 100.0% და სპეციფიკა 88.7% საშვილოსნოს ყელის კიბოსთვის (სურათი 4B) და 82.1% მგრძნობელობა და 88.7% სპეციფიკა HSIL+ ნიმუშებისთვის30.PCDHGB7 ასევე აქვს 90,9% მგრძნობელობა და 90,4% სპეციფიკა საშვილოსნოს ყელის კიბოს ვაგინალური სეკრეციის ნიმუშებში, რომელთა შეგროვება ბევრად უფრო ადვილია30.მაღალი რისკის (სთ) HPV ტესტთან ან Thinprep ციტოლოგიურ ტესტთან (TCT) კომბინირებისას, PCDHGB7 აქვს გაზრდილი მგრძნობელობა 95.7% და სპეციფიკა 96.2%, მნიშვნელოვნად აღემატება hrHPV ტესტის (20.3%), TCT (51.2%). ) და ორივე ერთად (57.8%) საშვილოსნოს ყელის კიბოსთვის30.ასევე ნაჩვენებია, რომ PCDHGB7 ჰიპერმეთილირებულია კიბოს 17 ტიპში TCGA მონაცემთა ბაზიდან, რაც მიუთითებს მის ვარგისიანობაზე UCOM-ის ოჯახში30.
სურათი 4 UCOM-ები დადასტურებულია კიბოს ოთხ ტიპზე ფართომასშტაბიან კლინიკურ კვლევებში.ა. HIST1H4F, UCOM-ის შესრულება 508 ნიმუშის ფილტვის კიბოს გამოვლენაში.B. PCDHGB7, UCOM-ის ეფექტურობა საშვილოსნოს ყელის კიბოს გამოვლენაში 844 ნიმუშში.C. PCDHGB7, UCOM-ის შესრულება, ენდომეტრიუმის კიბოს გამოვლენისას 577 ენდომეტრიუმის პაპ და ტაოს ფუნჯის ნიმუშებში.დ. SIX6-ის, UCOM-ის შესრულება, 177 ნიმუშის უროთელიუმის კიბოს გამოვლენაში.
EC
EC არის ქალის რეპროდუქციული სისტემის ერთ-ერთი ყველაზე გავრცელებული კიბო მსოფლიოში, ყოველწლიურად დაახლოებით 4.2 მილიონი ახალი შემთხვევით და კიბოსთან დაკავშირებული სიკვდილიანობის 1%-ით1.ადრეულ სტადიაზე წარმატებული დიაგნოზით, EC განკურნებადია და აქვს 5-წლიანი გადარჩენის მაჩვენებელი 95% კიბოს I სტადიისთვის.პაციენტები, რომლებიც არიან სიმპტომატური, როგორიცაა საშვილოსნოს პათოლოგიური სისხლდენა, იღებენ პერიოდულ კლინიკურ შეფასებას და უტარდებათ ინვაზიური და მტკივნეული ბიოფსიის პროცედურები, მიუხედავად იმისა, რომ მხოლოდ 5%-10%-ს საბოლოოდ უვითარდება EC43.ტრანსვაგინალური ულტრაბგერა, როგორც გამოვლენის საერთო მეთოდი, მეტად არასანდოა ენდომეტრიუმის კეთილთვისებიანი და ავთვისებიანი ცვლილებების დიფერენცირების შეუძლებლობისა და ცრუ დადებითი მაღალი სიხშირის გამო44.
ჩატარდა შრატის CA-125-ის, ფართოდ დანერგილი EC ბიომარკერისა და PCDHGB7-ის პარალელური შედარება.შრატში CA-125 ჰქონდა მგრძნობელობა 24.8%, რაც ვარაუდობს, რომ CA-125 არის არაადეკვატური მარკერი EC-სთვის, მიუხედავად სპეციფიკის 92.3%31.PCDHGB7 გამოვლენამ Pap ფუნჯის ნიმუშების გამოყენებით გამოიღო მგრძნობელობა 80.65% და სპეციფიკა 82.81% ECatall სტადიებისთვის, ხოლო Tao ფუნჯს ჰქონდა მგრძნობელობა 61.29% და სპეციფიკა 95.31%31.PCDHGB7 დიაგნოსტიკური მოდელი, დაფუძნებული Me-qPCR-ზე, გამოიღო მგრძნობელობა 98,61%, სპეციფიკა 60,5% და საერთო სიზუსტე 85,5%, Pap და Tao ფუნჯის ნიმუშების გამოყენებით (სურათი 4C)31.
უროთელიუმის კიბო
უროთელური კიბო, რომელიც შედგება შარდის ბუშტის, თირკმლის მენჯის და შარდსაწვეთის კიბოსგან, იყო მეშვიდე ყველაზე ხშირად დიაგნოზირებული კიბო 2020 წელს მსოფლიოში, რამაც გამოიწვია ახალი შემთხვევების 5.2% და სიკვდილიანობის 3.9%.უროთელური კიბო, რომელთა 50%-ზე მეტი შარდის ბუშტის კიბოა, იყო მეოთხე ყველაზე ხშირად დიაგნოზირებული კიბო შეერთებულ შტატებში 2022 წელს, რაც შეადგენს ახლად დიაგნოზირებულ შემთხვევებს 11.6%-ს3.შარდის ბუშტის კიბოს დაახლოებით 75% კლასიფიცირებულია, როგორც არაკუნთოვანი ინვაზიური ბუშტის კიბო, რომელიც შეზღუდულია ლორწოვანი გარსით ან ლორწოვანი გარსით45.ცისტოსკოპიული ბიოფსია არის ოქროს სტანდარტი უროთელიუმის კიბოს დიაგნოსტირებისთვის, რომელიც ხორციელდება ფლუორესცენციის in situ ჰიბრიდიზაციის (FISH) და ციტოლოგიური ტესტებით.FISH-ს და ციტოლოგიას აქვს ცუდი დიაგნოსტიკური ეფექტურობა, ხოლო ცისტოსკოპია ინტრუზიულია და აქვს მიკროდაზიანებების გამოტოვების, დაზიანებების არასწორი ინტერპრეტაციის და კიბოს პოტენციურად გავრცელების ან რეციდივის გამომწვევი ძირითადი რისკი46.ადრე დადასტურებული UCOM, PCDHGB7, ასევე ნაჩვენები იყო ჰიპერმეთილირებული უროთელიუმის კიბოს დროს, ფართობით 0,86 მრუდის ქვეშ, რაც მიუთითებს პოტენციურ დიაგნოსტიკურ შესაძლებლობებზე30.მეტი UCOM-ის შემდგომი ვალიდაციისა და მეტი ნიმუშის ტიპების უკეთ დასაყენებლად, SIX6, ახალი UCOM, გამოიკვლია და აჩვენა შესანიშნავი დიაგნოსტიკური პოტენციალი უროთელიუმის კიბოს ადრეულ გამოვლენაში შარდის ნიმუშების გამოყენებით Me-qPCR პლატფორმაზე.SIX6-ის გამოვლენამ შარდის ნიმუშების გამოყენებით აჩვენა კონკურენტული მგრძნობელობა 86.7% და სპეციფიკა 90.8% (სურათი 4D), თუმცა იყო არაინვაზიური და ადვილად მისაღწევი32.SIX6-ის პოტენციალი მეტასტაზების მონიტორინგსა და მკურნალობის ეფექტურობის შეფასებაში ამჟამად გამოკვლევის პროცესშია.
მომავალი და გამოწვევები
UCOM-ებს აქვთ მრავლობითი კიბოს დიაგნოსტიკური პოტენციალი, მაგრამ ბევრი სამუშაოა გასაკეთებელი.ჩვენ ვაფართოვდით UCOM-ების ჩამონათვალს და აქტიურად ვამოწმებდით UCOM-ებს კიბოს სხვა ტიპებში, მათ შორის მათ შორის, რომლებიც ტრადიციულად ძნელად გამოვლენილია.TCGA მონაცემთა ბაზების ვალიდაციის შედეგებმა კიდევ უფრო დაადასტურა UCOM-ების გამოყენება კიბოს უფრო მეტ ტიპსა და უფრო მეტ სიტუაციაში.წინასწარი გამოკვლევით, UCOM-ებს აქვთ ქოლანგიოკარცინომასა და პანკრეასის ადენოკარცინომების ძლიერი დიაგნოსტიკური პოტენციალი, რომელთა დიაგნოსტიკა ადრეულ ეტაპზე თითქმის შეუძლებელია სკრინინგის მიმდინარე მეთოდებით32,47.UCOM-ებით იშვიათი კიბოს გამოვლენის უნარი შეიძლება გამოყენებულ იქნას მოცირკულირე სიმსივნის დნმ-ით (ctDNA) გაუმჯობესებული თხევადი ბიოფსიის პლატფორმით48.პლაზმური დნმ-ზე დაფუძნებული პან-კიბოს გამოვლენის პანელის მონაწილეობით ჩატარებულმა კვლევამ გამოავლინა მგრძნობელობა 57,9%49.მიუხედავად მაღალი სპეციფიკისა, საერთო შესრულება ცხადყოფს, რომ ჯერ კიდევ არსებობს გაუმჯობესების ადგილი.
UCOM-ების უნიკალურმა მახასიათებლებმა ასევე მხარი დაუჭირა UCOM-ის პოტენციალის გამოკვლევას მკურნალობის ეფექტურობის შეფასებასა და განმეორების მონიტორინგში.მყარ სიმსივნეებში რეაგირების შეფასების კრიტერიუმების (RECIST) მიხედვით, სამედიცინო ვიზუალიზაცია არის რეკომენდირებული მეთოდოლოგია რეციდივის მონიტორინგისა და მკურნალობის ეფექტურობის შეფასებისთვის, ხოლო სიმსივნური მარკერები გამოიყენება ცალკე შეფასებისთვის50.თუმცა, რეალურად ვიზუალიზაციის მიდგომებზე დიდ გავლენას ახდენს სიხშირე და დრო და, შესაბამისად, ექვემდებარება პაციენტებს უფრო მაღალი რისკისა და ხარჯების წინაშე51,52.SIX6 დადასტურებულია, რომ ემსახურება როგორც მკერდის კიბოს მეტასტაზების პროგნოზირებას32.თხევადი ბიოფსიაზე დაფუძნებული ctDNA მონიტორინგს საშუალებას აძლევს რეალურ დროში ზედამხედველობა მოხდეს მინიმალური ნარჩენი დაავადების რენტგენოლოგიურ გამოვლენამდე თვით ადრე, რაც იდეალურად აჭიანურებს და ხელს უშლის რეციდივთან დაკავშირებული კიბოს პროგრესირებას53.წინასწარი შედეგები ვარაუდობს, რომ UCOM-ები ასახავს კიბოს ჰიპერმეთილაციის დონეს რეალურ დროში ოპერაციისა და მკურნალობის შემდეგ დაუყოვნებლივ32.UCOM-ების მიერ გამოვლენილი მაღალი მგრძნობელობა და გამოყენებადობა მრავალი არაინტრუზიული ნიმუშის ტიპებში, საშუალებას აძლევს UCOM-ებს გამოიყენონ ზუსტი რეციდივის მონიტორინგის ბიომარკერი და შეინარჩუნონ მაღალი პაციენტის შესაბამისობა.
ამავდროულად, ტესტის საჯარო ხელმისაწვდომობა კიდევ ერთი მთავარი საკითხია, რომელიც დამატებით ძალისხმევას მოითხოვს.მიუხედავად იმისა, რომ UCOM-ის აღმოჩენის თანამშრომლობა მიღებულ იქნა უფრო მეტ საავადმყოფოში იმ იმედით, რომ მეტი პაციენტის სარგებლობა მოაქვს, პრო ბონო გამოვლენა და სკრინინგები აქტიურად ტარდებოდა ჩინეთის სოფლებში.UCOM–ები საჭიროებენ გაუმჯობესებულ ხელმისაწვდომობას, რათა კვალიფიცირდნენ როგორც შესაძლებელი სკრინინგის ინსტრუმენტი, განსაკუთრებით განუვითარებელი ტერიტორიებისთვის.
მიუხედავად იმისა, რომ UCOM აპლიკაციის შედეგები ადრეულ გამოვლენაში პერსპექტიულია, UCOM-ის შესახებ ბევრი უცნობია.აქტიური გამოკვლევით, გარანტირებულია დამატებითი კვლევები იმის შესახებ, თუ რატომ არის UCOM-ები საყოველთაოდ წარმოდგენილი კიბოს დროს.UCOM-ის ძირითადი ეპიგენეტიკური რეგულირების მექანიზმები იმსახურებს შემდგომ გამოკვლევას, რამაც შეიძლება გაამართლოს კიბოს თერაპიის ახალი მიმართულება.სიმსივნის ჰომოგენურობასა და ჰეტეროგენურობას შორის ურთიერთკავშირს რომ დავუბრუნდეთ, ჩვენ გვაინტერესებს, რატომ შეიძლება UCOM იყოს გამონაკლისი კიბოს ბიომარკერების უმრავლესობისგან, რომლებიც მჭიდროდ არის დაკავშირებული კიბოს სპეციფიკურ ტიპებთან.UCOM-ის მიერ იდენტიფიცირებული დნმ-ის მეთილაციის აბერაციების როლი სიმსივნის გენეზში, სიმსივნის პროგრესირებასა და მეტასტაზებში არ არის განსაზღვრული უჯრედის იდენტურობის დაკარგვისა და აღდგენის პროცესში და საჭიროებს საფუძვლიან შემოწმებას.კიდევ ერთი მთავარი ინტერესი მდგომარეობს UCOM-ების ჰომოგენურობის მახასიათებლის ინკორპორაციაში ქსოვილის უნიკალური მარკერებით იმ იმედით, რომ მივუახლოვდებით კიბოს კვალის ზუსტი გამოვლენას და სიმსივნური ქსოვილის წარმოშობის იდენტიფიკაციას საპირისპირო გზით.UCOM შეიძლება იყოს იდეალური ინსტრუმენტი კიბოს თავიდან ასაცილებლად, კიბოს აღმოსაჩენად და კიბოს პოტენციურად დასაცავად და აღმოსაფხვრელად.
მხარდაჭერის გაცემა
ამ სამუშაოს მხარი დაუჭირა ჩინეთის ეროვნული საკვანძო R&D პროგრამა (გრანტი No. 2022BEG01003), ჩინეთის ეროვნული საბუნებისმეტყველო მეცნიერების ფონდი (გრანტის Nos. 32270645 და 32000505), გრანტი ჰეილონჯიანგის პროვინციული ჯანდაცვის კომისიიდან (გრანტი No. 2020-11) , და გრანტი ჰეზეს მეცნიერებისა და ტექნოლოგიების ინსტიტუტისგან (გრანტი No. 2021KJPT07).
ინტერესთა კონფლიქტის განცხადება
Wei Li არის R&D დირექტორი Shanghai Epiprobe Biotechnology Co., Ltd. Wenqiang Yu მუშაობს Epiprobe-ის სამეცნიერო მრჩეველთა საბჭოში.W. Yu-მ და Epiprobe-მა დაამტკიცეს ამ სამუშაოსთან დაკავშირებული მომლოდინე პატენტები.ყველა სხვა ავტორი არ აცხადებს კონკურენტ ინტერესებს.
ავტორის წვლილი
ჩაფიქრებული და დაპროექტებული პროექტი: Chengchen Qian და Wenqiang Yu.
დაწერა ნაშრომი: Chengchen Qian.
შეასრულა ილუსტრაციები: Chengchen Qian.
გადახედა და დაარედაქტირა ხელნაწერი: Xiaolong Zou, Wei Li, Yinshan Li და Wenqiang Yu.
ცნობები
1. Sung H, Ferlay J, Siegel RL, LaversanneM, Soerjomataram I, Jemal A, და სხვ.კიბოს გლობალური სტატისტიკა 2020: GLOBOCAN-ის შეფასებით
სიხშირე და სიკვდილიანობა მსოფლიოში 36 კიბოსთვის 185 ქვეყანაში.CA კირჩხიბი J Clin.2021 წელი;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S, და სხვ.კიბოს სტატისტიკა ჩინეთში და შეერთებულ შტატებში, 2022: პროფილები, ტენდენციები და განმსაზღვრელი.Chin MedJ (ინგლისური).2022 წელი;135: 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.კიბოს სტატისტიკა, 2023. CA Cancer J Clin.2023;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M, და სხვ.კიბოს ადრეული გამოვლენა.მეცნიერება.2022 წელი;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.სტრატეგიები
კოლორექტალური კიბოს სკრინინგი.გასტროენტეროლოგია.2020 წელი;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.ფილტვის კიბოს სკრინინგი.Am J Respir Crit Care Med.2015 წელი;191: 19-33.
7. Bouvard V, WentzensenN, Mackie A, Berkhof J, BrothertonJ, Giorgi-Rossi P, et al.IARC პერსპექტივა საშვილოსნოს ყელის კიბოს სკრინინგზე.N EnglJ Med.2021 წელი;385: 1908-18 წწ.
8. Xue P, Ng MTA, QiaoY.კოლპოსკოპიის გამოწვევები საშვილოსნოს ყელის კიბოს სკრინინგისთვის LMIC-ებში და ხელოვნური ინტელექტის გადაწყვეტილებები.BMC Med.2020 წელი;18: 169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.ცირკულირებადი ბიომარკერები ჰეპატოცელულური კარცინომის დიაგნოზსა და მართვაში.Nat Rev გასტროენტეროლი ჰეპატოლი.2022 წელი;19: 670-81 წწ.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. შრატის PSA-ზე დაფუძნებული პროსტატის კიბოს ადრეული გამოვლენა ევროპაში და გლობალურად: წარსული, აწმყო და მომავალი.ნატ რევ უროლი.2022 წელი;19:
562-72 წწ.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
და სხვ.მულტიპლექსური რნმ შარდის ტესტის შემუშავება შარდის ბუშტის გარდამავალი უჯრედული კარცინომის გამოვლენისა და სტრატიფიკაციისთვის.Clin Cancer Res.2008 წელი;14: 742-9.
12. Feinberg AP, Vogelstein B. ჰიპომეთილაცია განასხვავებს ზოგიერთი ადამიანის კიბოს გენებს მათი ნორმალური კოლეგებისგან.Ბუნება.1983 წელი;301: 89-92.
13. Ng JM, Yu J. სიმსივნის სუპრესორული გენების ჰიპერმეთილაციის პრომოტორი, როგორც პოტენციური ბიომარკერები კოლორექტალური კიბოს დროს.IntJ Mol Sci.2015 წელი;16: 2472-96.
14. Esteller M. კიბოს ეპიგენომიკა: დნმ-ის მეთილომები და ჰისტონის მოდიფიკაციის რუქები.ნატ რევ ჟენეტი.2007 წელი;8: 286-98.
15. Nishiyama A, Nakanishi M. ნავიგაცია კიბოს დნმ-ის მეთილაციის ლანდშაფტზე.ტენდენციები Genet.2021 წელი;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P, et al.ადამიანის ემბრიონის ღეროვანი უჯრედების მრავალხაზოვანი დიფერენციაციის ეპიგენომიური ანალიზი.უჯრედი.2013 წელი;153: 1134-48 წწ.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X და სხვ.გენომის მასშტაბური ანალიზები აჩვენებენ Polycomb-ის როლს დნმ-ის მეთილაციის ხეობების ჰიპომეთილაციის ხელშეწყობაში.გენომის ბიოლ.2018 წელი;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
და სხვ.კიბოს დროს დნმ-ის მეთილაციის ანალიზი: განმეორებითი მდებარეობა.ნატ რევ კლინ ონკოლ.2018 წელი;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D, et al.მეთილაციაზე დაფუძნებული მიზანმიმართული მრავალ კიბოს ადრეული გამოვლენის ტესტის კლინიკური ვალიდაცია დამოუკიდებელი ვალიდაციის ნაკრების გამოყენებით.ენ ონკოლი.2021 წელი;32: 1167-77 წწ.
20. Hanahan D, Weinberg RA.კიბოს დამახასიათებელი ნიშნები.უჯრედი.2000;100: 57-70.
21. Hanahan D. კიბოს ნიშნები: ახალი ზომები.კირჩხიბი Discov.2022 წელი;12: 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. ზუსტი ონკოლოგია: ვინ, როგორ, რა, როდის და როდის არა?Am Soc Clin Oncol Educ Book.2017: 160-9.
23. Liu H, Meng X, Wang J. რეალურ დროში რაოდენობრივი მეთილაცია
PAX1 გენის გამოვლენა საშვილოსნოს ყელის კიბოს სკრინინგში.IntJ გინეკოლის კიბო.2020 წელი;30: 1488-92 წწ.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP, et al.Multitargetstool დნმ ტესტირება კოლორექტალური კიბოს სკრინინგისთვის.N EnglJ Med.2014 წელი;370: 1287-97 წწ.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S, და სხვ.გიდის პოზიციონირება
თანმიმდევრობა განსაზღვრავს დნმ-ის მეთილაციის არასწორ შაბლონებს, რომლებიც ცვლის უჯრედის იდენტობას და სიმსივნურ-იმუნურ ზედამხედველობის ქსელებს.გენომი
რეზ.2019 წელი;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY და სხვ.არაინტრუზიული მრავალ კიბოს გამოვლენა მოცირკულირე უჯრედისგან თავისუფალი დნმ-ის მეთილაციის თანმიმდევრობით (THUNDER): განვითარებისა და დამოუკიდებელი ვალიდაციის კვლევები.ენ ონკოლი.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B, et al.ჰისტონთან დაკავშირებული გენები ჰიპერმეთილირებულია ფილტვის კიბოს დროს და ჰიპერმეთილირებული
HIST1H4F შეიძლება იყოს პან-კიბოს ბიომარკერად.კიბოს რეზ.2019 წელი;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V, et al.პროსტატის სპეციფიკური ანტიგენის სკრინინგის სიცოცხლის ხარისხის ეფექტები.N EnglJ Med.2012 წელი;367: 595-605 წწ.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. კიბოს სკრინინგის ბიომარკერული ტესტების კლინიკური ეფექტურობა, შემოთავაზებული როგორც თვითგადახდის ჯანმრთელობის სერვისი: სისტემატური მიმოხილვა.Eur J საზოგადოებრივი ჯანმრთელობა.2016 წელი;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z, და სხვ.
ჰიპერმეთილირებული PCDHGB7, როგორც მხოლოდ კიბოს უნივერსალური მარკერი და მისი გამოყენება საშვილოსნოს ყელის კიბოს ადრეულ სკრინინგში.Clin Transl Med.2021 წელი;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X, და სხვ.ჰიპერმეთილირებული PCDHGB7, როგორც ბიომარკერი ენდომეტრიუმის კიბოს ადრეული გამოვლენისთვის ენდომეტრიუმის ჯაგრისის ნიმუშებში და საშვილოსნოს ყელის სკრაპინგში.წინა Mol Biosci.2022 წელი;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F, et al.ორმხრივად
ექსკლუზიური ეპიგენეტიკური მოდიფიკაცია SIX6-ზე ჰიპერმეთილაციით კიბოსწინარე სტადიისა და მეტასტაზების გაჩენის კვალიფიკაციისთვის.სიგნალის გადამცემი სამიზნე იქ.2022 წელი;7: 208.
33. Huang L, Guo Z, Wang F, Fu L. KRAS მუტაცია: კიბოში წამალიდან წამალამდე.სიგნალის გადამცემი სამიზნე იქ.2021 წელი;6: 386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE, და სხვ.p16-ის (INK4a) არათანაბარი მეთილაცია არის ადრეული მოვლენა ფილტვის კიბოს დროს და პოტენციური ბიომარკერია ადრეული დიაგნოსტიკისთვის.Proc Natl Acad Sci U SA.1998 წელი;95: 11891-6.
35. რობერტსონი კ.დ.დნმ-ის მეთილაცია და ადამიანის დაავადება.ნატ რევ ჟენეტი.2005 წელი;6: 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C და სხვ.მრავალჯერადი ბიოფსია და საშვილოსნოს ყელის კიბოს წინამორბედების გამოვლენა კოლპოსკოპიის დროს.ჯ კლინ ონკოლ.2015 წელი;33: 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD, et al.FAM19A4-ის მეთილაციის ანალიზი
საშვილოსნოს ყელის ნაკაწრების გენი ძალიან ეფექტურია საშვილოსნოს ყელის გამოვლენაში
კარცინომა და მოწინავე CIN2/3 დაზიანებები.Cancer Prev Res (ფილა).2014 წელი;7: 1251-7.
38. Thai AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.ფილტვის კიბო.ლანცეტი.2021 წელი;398: 535-54.
39. გრუნეტი მ, სორენსენი ჯ.ბ.კარცინოემბრიონული ანტიგენი (CEA), როგორც სიმსივნის მარკერი ფილტვის კიბოს დროს.ფილტვის კიბო.2012 წელი;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L, და სხვ.ფილტვის კიბოს სკრინინგი, ვერსია 3.2018, NCCN კლინიკური პრაქტიკის გაიდლაინები ონკოლოგიაში.J Natl Compr Canc Netw.2018 წელი;16: 412-41.
41. ამერიკის კიბოს საზოგადოება.კიბოს შესახებ ფაქტები და ციფრები.ატლანტა, GA, აშშ: ამერიკის კიბოს საზოგადოება;2023 [განახლებულია 2023 1 მარტი;ციტირებულია 2023 წლის 22 აგვისტო].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
ჰერციგ ა და სხვ.საშვილოსნოს ყელის კიბოს სკრინინგი საშუალო რისკის მქონე პირებისთვის: 2020 წლის გაიდლაინის განახლება ამერიკის კიბოს საზოგადოებისგან.CA კირჩხიბი J Clin.2020 წელი;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. ასოციაცია ენდომეტრიუმის კიბოს რისკი პოსტმენოპაუზის სისხლდენასთან ქალებში: სისტემატური მიმოხილვა და მეტა-ანალიზი.JAMA სტაჟიორი მედ.2018 წელი;178: 1210-22 წწ.
44. Jacobs I, Gentry-MaharajA, Burnell M, ManchandaR, Singh N,
შარმა ა და სხვ.ტრანსვაგინალური ულტრაბგერითი სკრინინგის მგრძნობელობა
ენდომეტრიუმის კიბოსთვის პოსტმენოპაუზის ქალებში: შემთხვევის კონტროლის კვლევა UKCTOCS კოჰორტაში.ლანსეტ ონკოლი.2011 წელი;12: 38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ და სხვ.ევროპის უროლოგიის ასოციაციის გაიდლაინები შარდის ბუშტის არა-კუნთოვანი ინვაზიური კიბოს შესახებ (TaT1 და კარცინომა In Situ) -
2019 წლის განახლება.ევრო უროლი.2019 წელი;76: 639-57.
46. არაგონ-ჩინგ ჯ.ბ.გამოწვევები და მიღწევები უროთელიუმის ზედა ტრაქტისა და შარდის ბუშტის კარცინომის დიაგნოსტიკაში, ბიოლოგიასა და მკურნალობაში.უროლ ონკოლი.2017 წელი;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
ქოლანგიოკარცინომა – განვითარებადი კონცეფციები და თერაპიული სტრატეგიები.ნატ რევ კლინ ონკოლ.2018 წელი;15: 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. თხევადი ბიოფსია ჰეპატოცელულურში
კარცინომა: მოცირკულირე სიმსივნური უჯრედები და მოცირკულირე სიმსივნური დნმ.მოლი კიბო.2019 წელი;18: 114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K, და სხვ.პან-კიბო
მოცირკულირე სიმსივნის დნმ-ის აღმოჩენა 10000-ზე მეტ ჩინელ პაციენტში.ნატ კომუნ.2021 წელი;12:11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R, et al.პასუხის შეფასების ახალი კრიტერიუმები მყარ სიმსივნეებში: შესწორებული RECIST გაიდლაინი (ვერსია 1.1).ევრო J კირჩხიბი.2009 წელი;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST - სწავლა წარსულიდან მომავლის ასაშენებლად.ნატ რევ კლინ ონკოლ.
2017 წელი;14: 187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S, et al.iRECIST: გაიდლაინები პასუხის კრიტერიუმებისთვის საცდელებში გამოსაყენებლად
იმუნოთერაპიული საშუალებების ტესტირება.ლანსეტ ონკოლი.2017 წელი;18: e143-52.
53. PantelK, Alix-Panabières C. თხევადი ბიოფსია და მინიმალური ნარჩენი დაავადება - უახლესი მიღწევები და შედეგები განკურნებაზე.ნატ რევ კლინ ონკოლ.2019 წელი;16: 409-24.
მოიხსენიეთ ეს სტატია, როგორც: Qian C, Zou X, Li W, Li Y, Yu W. ფორპოსტი კიბოს წინააღმდეგ: უნივერსალური კიბოს მხოლოდ მარკერები.კიბოს ბიოლ მედ.2023;20: 806-815 წწ.
doi: 10.20892/j.issn.2095-3941.2023.0313
გამოქვეყნების დრო: მაისი-07-2024